「アミノ酸配列:機能を秘めた“暗号”」(第1回)
タンパク質って、そもそも何?
「タンパク質」と聞くと、まず思い浮かぶのは食べ物や栄養の話かもしれません。
でも実は、タンパク質は私たちの身体の中で
動く・反応する・形をつくる ―
そんな大切な“働き手”として活躍している分子です。
科学の言葉では、タンパク質は「高分子」と呼ばれます。
これは、小さなパーツがたくさんつながってできた大きな分子という意味で、
サイズは数ナノメートル(100万分の1ミリメートル)から、
1000ナノメートルを超えるものまでさまざまです。
アミノ酸という「たった20種類の部品」
このタンパク質をつくっているのが、「アミノ酸」と呼ばれる小さな分子たち。
驚くことに、たった20種類のアミノ酸の組み合わせだけで、
地球上にある無数のタンパク質が作られているのです!
アミノ酸は、中心となる炭素原子(C)に
以下の4つが結びついた構造を持っています:
- アミノ基(−NH₂):弱いアルカリ性
- カルボキシル基(−COOH):弱い酸性
- 水素原子(−H)
-
側鎖:アミノ酸ごとに異なる部分で、
その性質を決めるカギ
このような構造をもつことで、
アミノ酸はそれぞれ異なる“性格”を持つようになります。
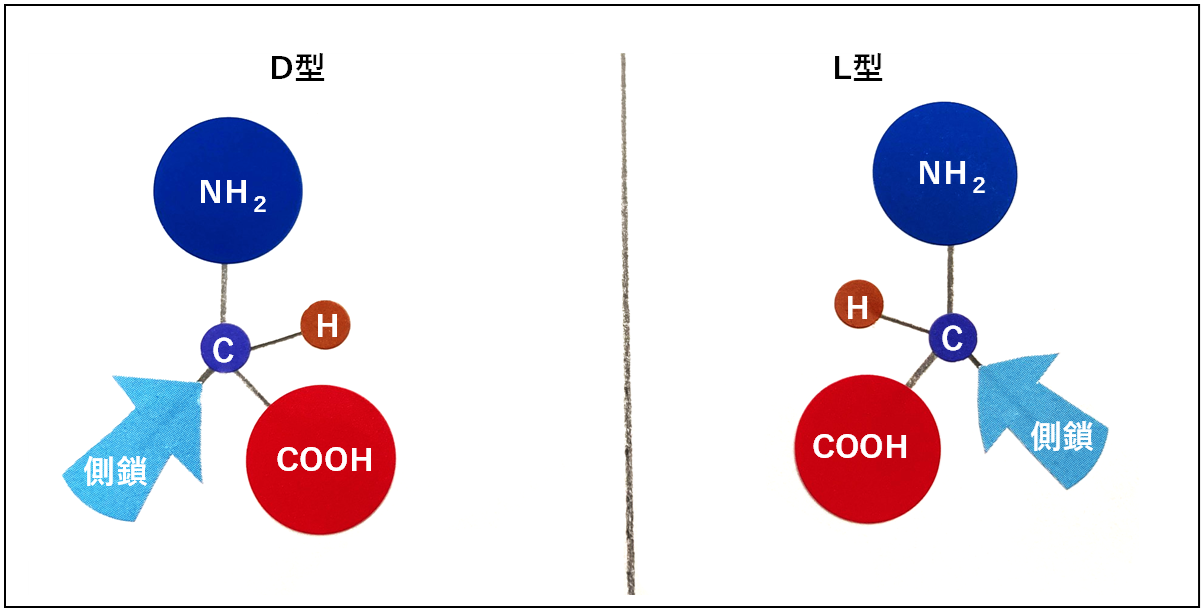
L型とD型―鏡のようなふたつの形
さらにおもしろいのは、アミノ酸には
「鏡に映したような2つの形(光学異性体)」があること(図1)。
自然界のタンパク質では、ほぼすべてが
「L型」というタイプのアミノ酸だけでできているのです。
不思議ですよね?
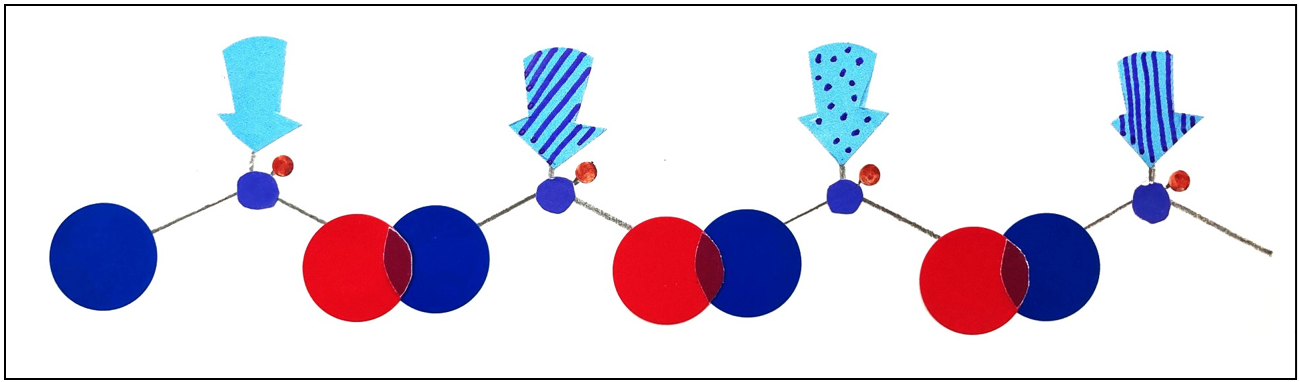
並び順に意味がある!アミノ酸配列の力
アミノ酸は、「脱水縮合」という反応で鎖のようにつながり、
「ポリペプチド鎖」や「タンパク質」になります(図2)。
このときの並び順(アミノ酸配列)こそが、
タンパク質の性質と働きを決める最大のカギなのです。
たとえば、糖尿病の治療に欠かせないホルモン「インスリン」は、
わずか51個のアミノ酸からできている小さなタンパク質。
その配列を世界で初めて明らかにしたのが、
フレデリック・サンガー博士です。
1958年にノーベル化学賞を受賞しました。
アミノ酸の並びは、まさに生命の“暗号”。
20世紀の生命科学では、
その暗号を読み解くことが大きなテーマだったのです。
遺伝子からタンパク質へ ― 情報の流れ
21世紀の今では、DNAの塩基配列
(A・T・G・Cの並び)を読むことで、
そこから導かれるアミノ酸配列も
すぐに予測できるようになりました。
この流れは「セントラルドグマ」と呼ばれます:
DNA → RNA → タンパク質
これにより、ヒトをはじめさまざまな生き物が、
どんなタンパク質を作るかを
“設計図”レベルで把握できるようになったのです。
アミノ酸配列に、まだ見ぬヒミツが
とはいえ、アミノ酸配列がわかるだけでは、
タンパク質のすべてを理解することはできません。
最近の研究では、タンパク質の特定のアミノ酸に対して、
「修飾」と呼ばれる変化 ―
たとえば、アミノ酸以外の物質が結合したり、
化学的に性質が変わったりすること ―
が起こることが明らかになってきました。
こうした修飾が、タンパク質の働きを調整したり、
病気の発症に関わっていたりすることも
分かりはじめています。
だからこそ、配列の情報だけでは見えてこない、
タンパク質の「かたち」や「動き」そのものを
“目で見る”ことが、
ますます重要になってきているのです。
一緒に探検してみませんか?
この連載では、タンパク質という不思議な世界を、
全12回にわたって探っていきます。
研究の世界に興味を持ち始めた方も、
初めて生物の仕組みに触れる方も、
ぜひこの旅にご一緒ください。
きっと、新しい発見と驚きが待っているはずです。