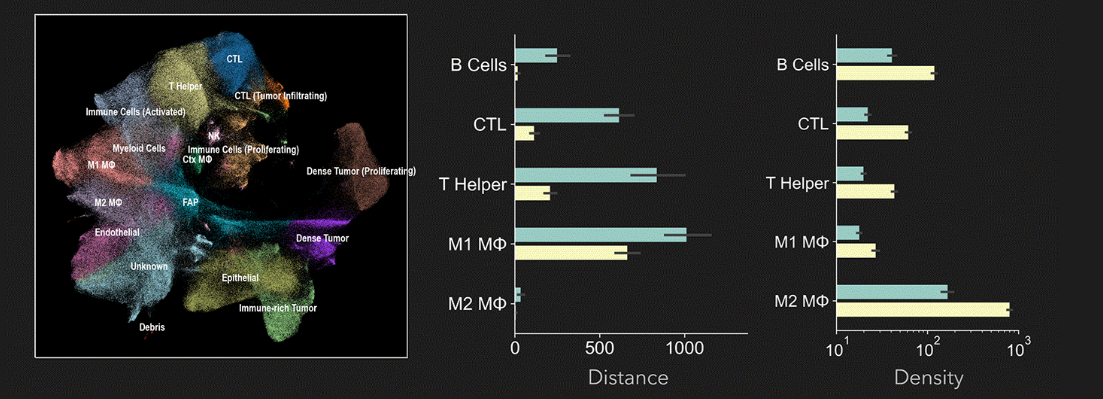
臨床的有用性への道:空間トランスクリプトミクスからタンパク質プロファイリングへ
空間バイオロジーは、イメージング技術を活用して人類の健康の向上に貢献する、急速に発展している分野です。この領域には、全トランスクリプトーム解析から、臨床的に意義のある単一タンパク質バイオマーカー検査まで、幅広い研究活動が含まれます。
全トランスクリプトームから得られた知見をもとに、臨床的に有用なタンパク質プロファイリングパネルを構築しようとするトランスレーショナル研究者は、特有の課題に直面します。すなわち、パネルに含めるバイオマーカーの選定、安定した結果を得るための試薬の検証、さらには臨床アウトカムと統計的に結び付けるための多数の臨床サンプル測定などが求められます。
トランスレーショナル空間バイオロジー研究は、組織微小環境を大規模に定量化し、患者ケアの改善につながる作用機序的・予後的・予測的なインサイトを引き出します。この文脈では、タンパク質レベルでの解析は、疾患メカニズムの理解や治療効果の評価におけるゴールドスタンダードと されています。研究者にとっての中心的な課題は、「臨床研究に必要となる十分なスループットを確保しながら、生物学的複雑性を適切に捉えられる臨床的に関連性の高いバイオマーカーパネルをどのように設計するか」です。

探索から臨床的価値へ
過去10年間、空間トランスクリプトミクス技術を用いた探索研究により、臨床的価値を持つ可能性のある微小環境バイオマーカー候補が飛躍的に増加しました。その臨床的関連性を評価するには、トランスレーショナル研究が不可欠です。
まず、細胞の表現型や機能を規定するタンパク質発現に着目し、RNAリードをタンパク質レベルで検証します。その後、大規模コホート研究により、臨床アウトカムと結び付けた微小環境解析を行います。
空間トランスクリプトミクスから多重免疫蛍光(multiplex IF)パネル試験へ進む一般的なワークフローは、以下の通りです。
- 空間トランスクリプトミクスにより、組織内のRNAリード候補をショートリスト化する
- 免疫組織化学(IHC)を用いてRNAリードをタンパク質レベルで検証する
- 検証済みタンパク質マーカーと既存マーカーを組み合わせ、multiplex IFパネルを構築する
この段階で研究者は、「臨床的に意味のある空間バイオマーカーを、大規模コホート研究による統計的裏付けとともに導出するために、十分なスループットと多重度を持つ空間タンパク質プロファイリング技術とは何か?」という問いに直面します。
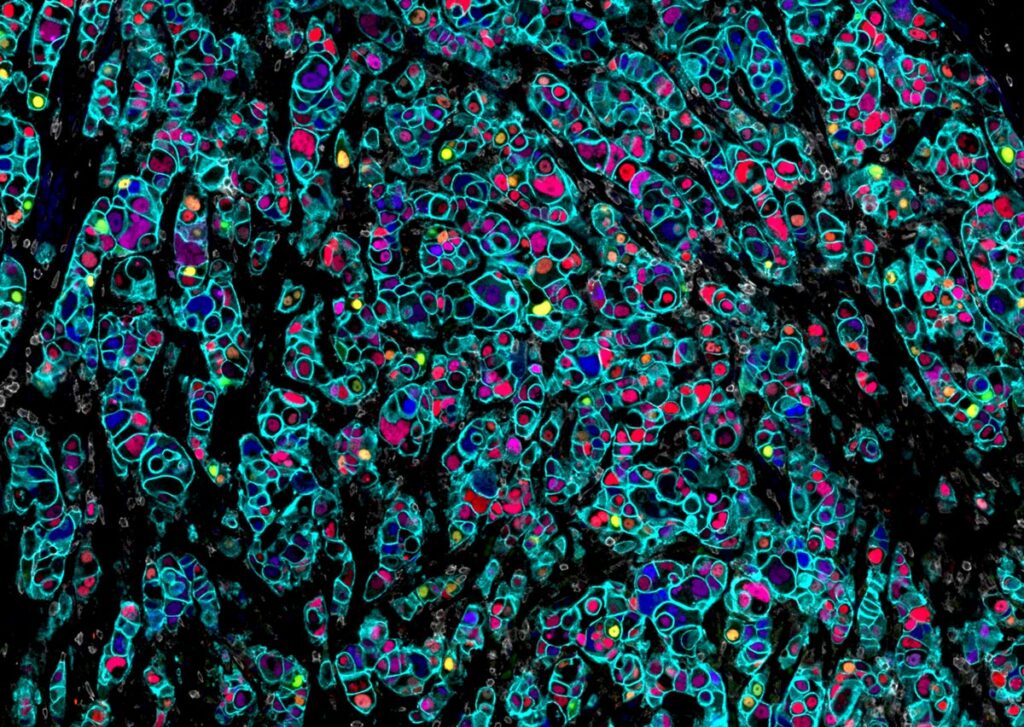
「トランスクリプトミクスなどの探索技術により、臨床的価値の可能性があるバイオマーカーが多数見出されています。現在の課題は、それらの有用なRNAリードを、臨床的有用性を評価するための大規模コホート研究に適用できる優れたバイオマーカーパネルに統合することです。」
— RareCyte Inc. 生物学R&D 副社長 Tad George
従来技術の限界を乗り越えるために
トランスレーショナル研究における空間バイオロジーでは、微小環境を十分に解像できる多重度を備えた信頼性の高いパネルの開発と、統計的に意味のある臨床インサイトを得るための高スループット測定が必要です。臨床的に価値のあるバイオマーカーパネルを大規模コホートで確立するには、高スループットのタンパク質解析が不可欠ですが、実際には、1ラウンドで測定可能なマーカー数がスループットの制約となることが多くあります。従来の多重IF技術は1ラウンドあたり2〜6マーカーに限られることが多く、研究の深さに限界が生じます。測定可能なタンパク質マーカー数が増えるほど、生物学的インサイトは広がり、データ品質も向上します。
Orion™は1ラウンドで20チャネル(17マーカー + 核1ch + 自家蛍光2ch)の取得が可能で、この制約を大きく改善します。パネルが1ラウンドに収まらない場合でも、少数サンプルでのサイクリングにより単一ラウンドで対応可能なマーカー組み合わせを見極めることができますが、サイクリングが増えるほど時間、劣化リスク、スループット低下が生じます。そのため、1ラウンドでより多くのマーカーを取得できるOrionは、必要なサイクル数を最小化し、ワークフローを効率化しつつデータ品質を向上させます。
臨床研究に必要なplex数については、ハーバード大学 Peter Sorger 博士のグループはこちらの論文で、現在の臨床研究の標準は5〜6-plexであるものの、腫瘍プロファイリングには最低10〜16マーカーが必要であると述べています。
multiplex IFパネル設計には、抗体の選択以外にも以下の課題があります。
- 各抗体がプラットフォームと互換性を持つかを厳密に検証し、正確で再現性のある結果を確保する必要がある
- 新規ターゲットを扱う場合、カスタム試薬を作製・検証できることが重要
- 複数ラウンドで測定する場合、シグナル除去の完全性および抗原構造の保持を確認する必要がある
これらの要件を満たすことは、トランスレーショナル空間バイオロジー研究で高品質かつ再現性のあるデータを得るために不可欠です。
Orion™:トランスレーショナルギャップを埋ぐプラットフォーム
Orion™は、1ラウンドで20チャネルを同時検出できる能力により、空間バイオロジーにおける主要な制約を解消します。これにより、RNA探索フェーズからタンパク質レベルのトランスレーショナル研究へ、サンプルの状態やデータ品質を損なうことなく効率的に移行できます。
柔軟で高品質・高信頼のパネル開発
Orionのパネル開発ツールには、プレバリデーション済み試薬、市販パネル、カスタムマーカーを簡単に組み込めるラベリングキットが含まれます。これにより、パネル開発時間を大きく短縮できます。すべての抗体を1ラウンドで染色できるため、バリデーション作業がシンプルになり、データ品質も向上します。
大規模コホートに対応する高スループット・高plex
Orionは、微小環境を全切片レベルで解析するために必要な高スループットと高plex性能を備えています。数十から数百のサンプルを短時間で処理し、臨床アウトカムと関連付けられる、統計的に裏付けられた定量データを生成します。
探索とトランスレーショナルを単一プラットフォームで実現
Orionは、高plex探索パネルにも、単一ラウンドのトランスレーショナルパネルにも対応する唯一のプラットフォームです。 1ラウンドで20チャネルを取得でき、必要に応じてサイクリングによりさらに高いplexにも拡張可能です。これにより、例えば3ラウンドで51-plexの探索解析を行い、その後、臨床的に重要な単一ラウンドパネルへ絞り込んで高スループット検証を行うといった流れを、一台で完結できます。
まとめ
Orionは、多数のサンプルに対する高plex・高スループットの空間タンパク質解析を可能にし、臨床試験に必要なバイオマーカー検証を強力にサポートします。空間トランスクリプトミクスで得た探索結果と、タンパク質レベルでの機能的検証をつなぐことで、Orionはバイオマーカー探索から臨床研究への橋渡しを行い、空間バイオロジーの成果を患者のベネフィットへ迅速につなげます。